- 中文
- English
/

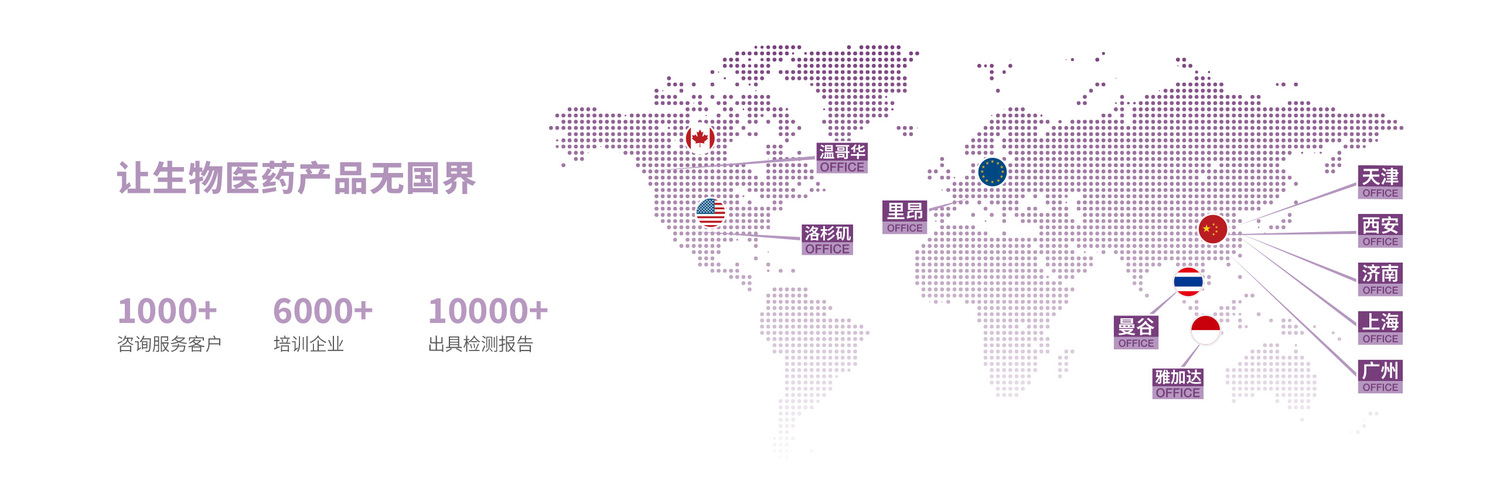
海河生物是一家專(zhuān)業(yè)為醫(yī)療器械、藥品研究和生產(chǎn)企業(yè)提供產(chǎn)品全生命周期的平臺(tái)性公司,具有極高的行業(yè)地位。
海河生物的醫(yī)療器械和藥品檢驗(yàn)檢測(cè)業(yè)務(wù),尤其是醫(yī)療器械檢測(cè)具有國(guó)內(nèi)、國(guó)際先進(jìn)檢測(cè)標(biāo)準(zhǔn)相關(guān)資質(zhì),可以做到一次
檢測(cè)滿足不同地區(qū)和市場(chǎng)的檢測(cè)要求。
海河生物的咨詢(xún)業(yè)務(wù)可以提供醫(yī)療器械、藥包材和藥品的法規(guī)咨詢(xún)、全球注冊(cè)認(rèn)證、質(zhì)量管理體系建立和審核、產(chǎn)品臨
床評(píng)價(jià)不良事件處理等服務(wù),協(xié)助我國(guó)多個(gè)醫(yī)療器械細(xì)分品類(lèi)完成了歐美監(jiān)管部門(mén)的收割審批。
了 解 更 多



|
| 委托生產(chǎn)/委托開(kāi)發(fā)生產(chǎn) CMO/CDMO |
| 質(zhì)量體系咨詢(xún) |
| 風(fēng)險(xiǎn)管理 |
| 醫(yī)療器械軟件確認(rèn) |
| 工藝設(shè)計(jì)開(kāi)發(fā)/設(shè)計(jì)轉(zhuǎn)化 |
| 設(shè)計(jì)驗(yàn)證/確認(rèn)策劃 |
| 生物學(xué)評(píng)價(jià) |
| 臨床前動(dòng)物實(shí)驗(yàn) |
| 重復(fù)使用再處理確認(rèn) |
| 產(chǎn)品性能測(cè)試/注冊(cè)檢測(cè) |
| 人因工程/可用性評(píng)價(jià) |
| 微生物試驗(yàn) |
| 網(wǎng)絡(luò)安全測(cè)試 |
| 包裝驗(yàn)證和有效期驗(yàn)證 |
| 電氣安全測(cè)試 |
| EMC測(cè)試 |
| 臨床評(píng)價(jià) |
| 法規(guī)和標(biāo)準(zhǔn)培訓(xùn) |
| 中國(guó) 醫(yī)療器械注冊(cè)證申報(bào) |
| 美國(guó) 510(k) 申請(qǐng) |
| 美國(guó) De NOVO / PMA |
| 歐盟 CE 認(rèn)證咨詢(xún) / 英國(guó) UKCA 認(rèn)證咨詢(xún) |
| 俄羅斯注冊(cè)咨詢(xún) / 獨(dú)聯(lián)體國(guó)家注冊(cè)咨詢(xún) |
| 加拿大 醫(yī)療器械許可證申請(qǐng) |
| 巴西 ANVISA 注冊(cè) |
| 質(zhì)量體系檢查支持 |
| 當(dāng)?shù)卮矸?wù) |
| 上市后臨床跟蹤 |
| 不良事件處理 |
| 召回服務(wù) |
| 產(chǎn)品變更/迭代法規(guī)調(diào)研和規(guī)劃 |
| 注冊(cè)/認(rèn)證變更 |
| 產(chǎn)品退市服務(wù) |
2025年7月20日(周日)17:00-18:00天津新聞廣播《一起天津》將迎來(lái)一場(chǎng)聚焦產(chǎn)業(yè)前沿的深度對(duì)話。天津市政協(xié)委員、天津海河生物醫(yī)藥科技集團(tuán)創(chuàng)始人兼董事長(zhǎng)洪曉鳴女士被譽(yù)為“生物醫(yī)藥CRO出海領(lǐng)航者”的行業(yè)領(lǐng)軍人物特約受邀做客節(jié)目,將與其他嘉賓圍繞“國(guó)際盛會(huì)下,天津生物醫(yī)藥企業(yè)的新契機(jī)”,共探產(chǎn)業(yè)升級(jí)與國(guó)際化之路,歡迎關(guān)注!洪曉鳴女士作為生物醫(yī)藥領(lǐng)域的杰出代表,在行業(yè)內(nèi)有著豐富的實(shí)踐經(jīng)...
海河要聞
更多>>
海河生物服務(wù)平臺(tái)巡展—化學(xué)分析和毒理學(xué)評(píng)價(jià)平臺(tái)原創(chuàng) 海河生物 海河生物視界 2025年06月24日 17:55 天津化學(xué)分析和毒理學(xué)評(píng)價(jià)平臺(tái)海河生物作為行業(yè)領(lǐng)先的生物醫(yī)藥合同研究組織(CRO),構(gòu)建了覆蓋材料表征 - 毒理評(píng)估 - 法規(guī)合規(guī)的一體化服務(wù)體系。 01核心技術(shù)優(yōu)勢(shì):硬實(shí)力與軟實(shí)力雙輪驅(qū)動(dòng)1. 國(guó)際化硬件配置檢測(cè)設(shè)備矩陣:配備 GC-MS、LC-MS(QTOF)、ICP-OES、X...
為加強(qiáng)醫(yī)療器械注冊(cè)管理,規(guī)范注冊(cè)申請(qǐng)人自檢工作,國(guó)家藥監(jiān)局組織起草了《醫(yī)療器械注冊(cè)自檢管理規(guī)定實(shí)施指南(征求意見(jiàn)稿)》,現(xiàn)向社會(huì)公開(kāi)征求意見(jiàn)。 請(qǐng)?zhí)顚?xiě)反饋意見(jiàn)表,并于2025年7月11日前反饋至ylqxzc @nmpa.gov.cn,電子郵件標(biāo)題請(qǐng)注明“醫(yī)療器械注冊(cè)自檢管理規(guī)定實(shí)施指南反饋意見(jiàn)”。 附件:1.醫(yī)療器械注冊(cè)自檢管理規(guī)定實(shí)施指南.doc2.反饋意見(jiàn)表(模板).doc 國(guó)家藥...
關(guān)于我們海河生物是一家專(zhuān)業(yè)為醫(yī)療器械、藥品研發(fā)和生產(chǎn)企業(yè)提供全生命周期服務(wù)的公司。海河生物旗下檢測(cè)機(jī)構(gòu)為集團(tuán)全資子公司,全流程可控,是國(guó)內(nèi)首家獲得國(guó)家級(jí)檢驗(yàn)檢測(cè)資質(zhì)認(rèn)定的非公有制醫(yī)療器械檢測(cè)機(jī)構(gòu),也是我國(guó)最早提供整套同時(shí)符合中國(guó)藥監(jiān)局和美國(guó)GLP標(biāo)準(zhǔn)的醫(yī)療器械臨床前研究的CRO公司,擁有多個(gè)國(guó)內(nèi)獨(dú)占醫(yī)療器械測(cè)試平臺(tái)。檢測(cè)機(jī)構(gòu)資質(zhì)齊全,已獲得國(guó)家級(jí)檢驗(yàn)檢測(cè)資質(zhì)認(rèn)定(CMA)、CNAS、美國(guó)AN...
海河生物邀您7月17日(周四)參加線上培訓(xùn),本次培訓(xùn)以「藥械組合類(lèi)產(chǎn)品NMPA和CE注冊(cè)要點(diǎn)」為核心,聚焦該類(lèi)產(chǎn)品在國(guó)內(nèi)外注冊(cè)申報(bào)中的關(guān)鍵難點(diǎn)與實(shí)操細(xì)節(jié),助力企業(yè)精準(zhǔn)把握合規(guī)路徑。報(bào)名方式可掃描或長(zhǎng)按識(shí)別二維碼完成線上報(bào)名關(guān)于海河生物海河生物是一家專(zhuān)業(yè)為醫(yī)療器械和藥品相關(guān)的研究機(jī)構(gòu)、研發(fā)和生產(chǎn)企業(yè)以及相關(guān)監(jiān)管部門(mén)提供產(chǎn)品全生命周期服務(wù)的平臺(tái)性公司,在生物醫(yī)藥CRO領(lǐng)域具有極高的行...
海河咨詢(xún):向客戶提供中國(guó)、美國(guó)、歐盟、巴西、加拿大和東南亞國(guó)家等國(guó)家地區(qū)的醫(yī)療器械、藥品和藥械結(jié)合產(chǎn)品全生命周期法規(guī)政策咨詢(xún)、注冊(cè)認(rèn)證輔導(dǎo)、上市后不良事件處理、技術(shù)轉(zhuǎn)化、培訓(xùn)等相關(guān)服務(wù)。海河CDMO:海河生物的醫(yī)療器械委托研發(fā)生產(chǎn)平臺(tái),是按照國(guó)家藥監(jiān)局醫(yī)療器械生產(chǎn)質(zhì)量管理規(guī)范、美國(guó)藥監(jiān)局 QSR 和 ISO13485 要求建立的為器械產(chǎn)學(xué)研、醫(yī)工轉(zhuǎn)化和初創(chuàng)型團(tuán)隊(duì)服務(wù)的平臺(tái),承接醫(yī)療器械產(chǎn)品定...
海河之光
更多>>
海河觀瞻
更多>>
慧聚海河
更多>>
海河學(xué)堂
更多>>
海河文庫(kù)
更多>>
|
|